Research
Eucaryotic cells have different intracellular compartments presenting a define protein and lipid composition that is required to ensure their function. This composition is ensured by membrane trafficking that is the formation of a transport vesicle at a donor compartment and its trafficking to an acceptor compartment before fusion and liberation of its protein and lipid content.
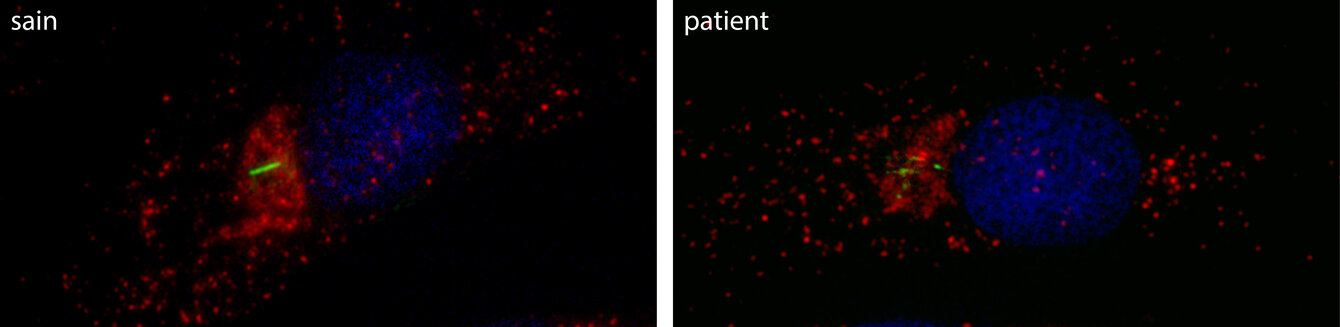
We use the yeast Saccharomyces cerevisiae, primary cells from patients and mice (knock-out and knock-in) cells and tissues as models to study human genes involved in diseases et coding for proteins of the membrane trafficking.

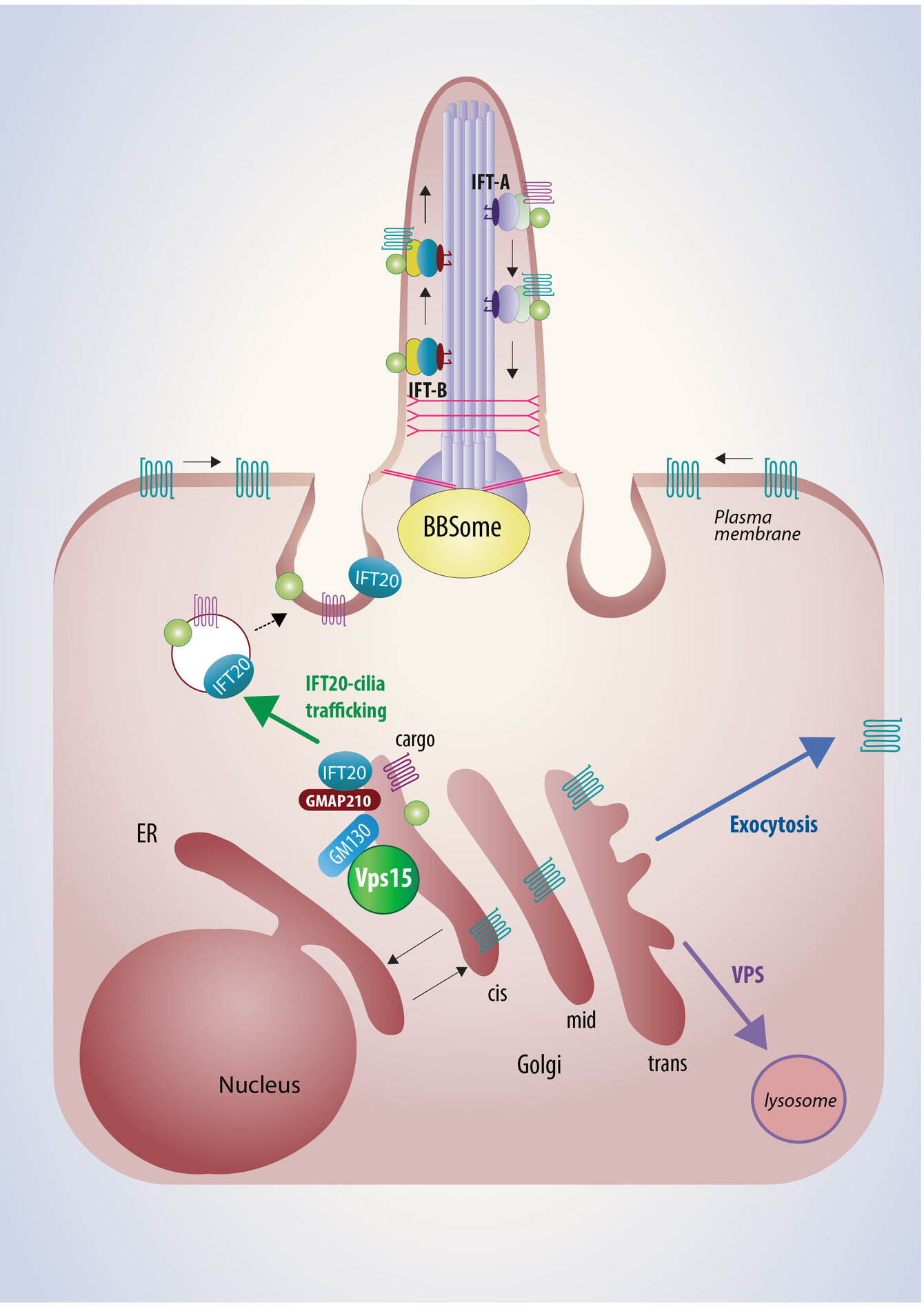
Schematic view of intracellular trafficking to the primary cilia
Our research focuses on different steps of membrane trafficking:
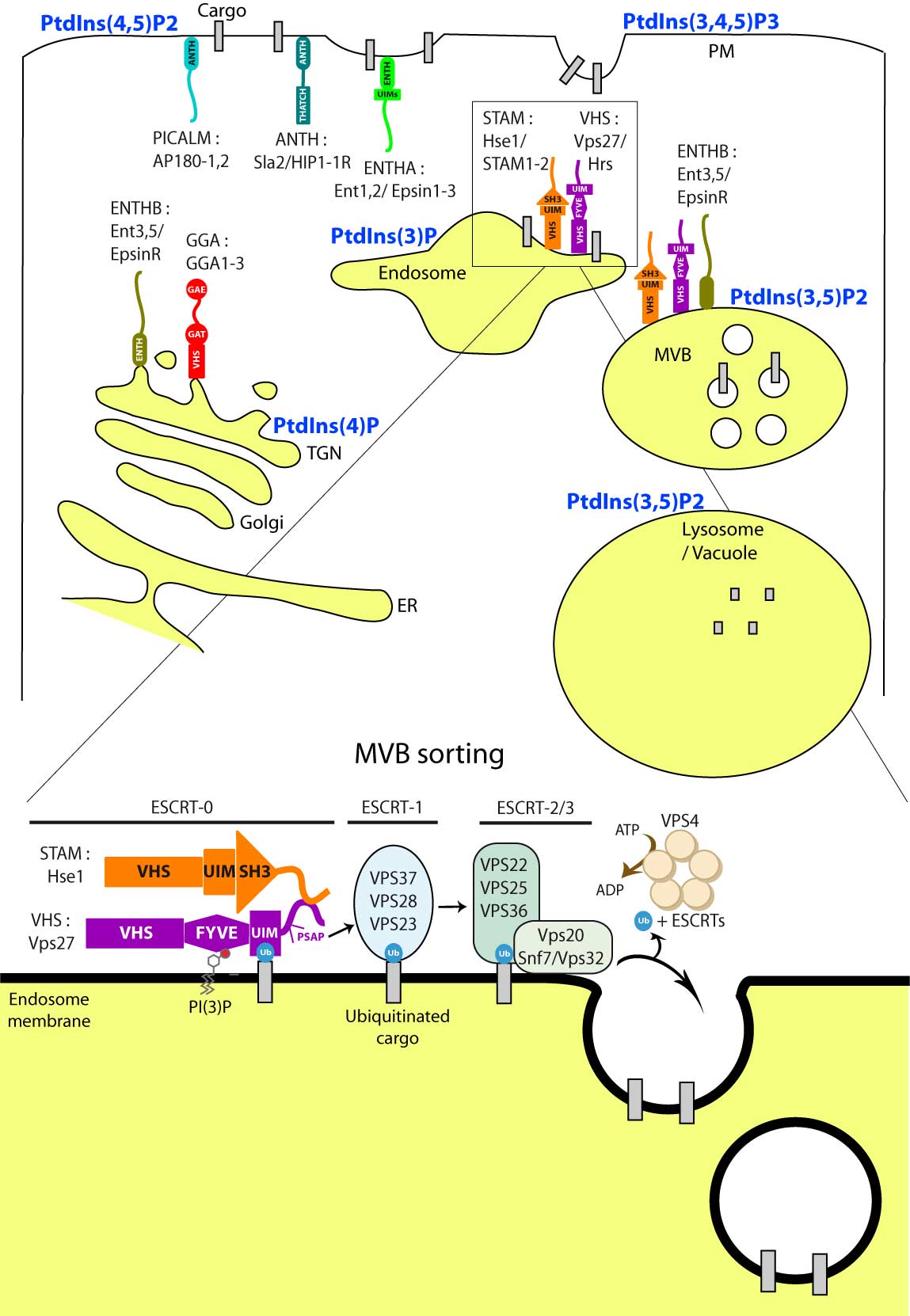
- internalization of proteins at the plasma membrane by endocytosis
- vesicular transport from the Golgi apparatus to the vacuole/lysosome
- protein sorting at the late endosome also termed the MVB (multivesicular body)
- transport of proteins to the primary cilia
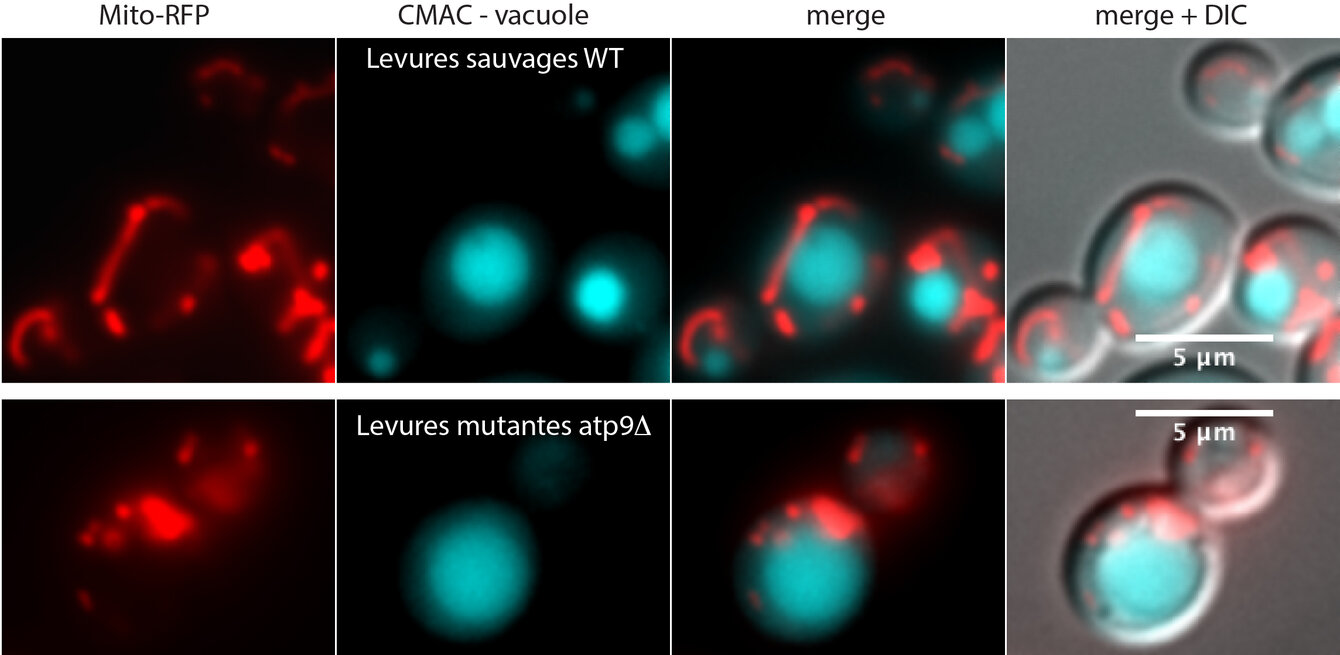
- transport of mitochondrial proteins and evolution of mitochondria

Mitochondria network (in red) and vacuoles (in blue) observation by fluorescent microscopy on living yeast cells, either wild-type or mutant for the mitochondrial ATP synthase ATP9.
We also aim at understanding the role of protein-lipid interactions in these different steps of membrane trafficking by focusing on one class of lipids, the phosphoinositides (PPIn). Indeed, phosphatidylinositol (PtdIns) is a key lipid in trafficking, since its inositol ring can be specifically phosphorylated at multiple positions, thus producing different molecules that serve as signals for trafficking:
- PtdIns4P, mono-phosphorylation at the 4 position of the inositol ring, enriched at the Golgi
- PtdIns(4,5)P2, bis-phosphorylation at the 4 and 5 positions of the inositol ring, enriched at the plasma membrane
- PtdIns(3,4,5)P3, tris-phosphorylation at the 3, 4 and 5 positions of the inositol ring, enriched at the plasma membrane
- PtdIns3P, mono-phosphorylation at the 3 position of the inositol ring, enriched at the endosomes
- PtdIns(3,5)P2, bis-phosphorylation at the 3 and 5 positions of the inositol ring, enriched at the late endosome (MVB) and vacuolar/lysosomal membrane
- PtdIns5P, mono-phosphorylation at the 5 position of the inositol ring, enriched at the plasma membrane
Biochemical technics (lipids, proteins, interactions), genetics (yeast KO strains, crossing, spore dissection, mice knockin and knockout, primary cells of patients), cellular biology and imaging (fluorescence microscopy) are currently used in the laboratory.
Moreover, by using humanization of yeast cells via heterologous expression, we study human genes responsible for myopathy (MTM1, BIN1, DNM2, PYROXD1), Charcot-Marie-Tooth neuropathy (MTMR2, DNM2) or ciliopathy (VPS15). We analyze the different phenotypes resulting from the expression of either wild-type or patient mutant forms of the human gene in a simple eukaryotic unicellular organism, the yeast S. cerevisiae.
The aim of our studies is to better understand the cellular mechanisms leading to these complex diseases, by characterizing cellular function of protein encoded by mutated genes and this in healthy and pathological conditions.
Video of the conference given by Sylvie Friant at the Vesicular Traffic Conference with the 3 Nobels 2013 (Collège de France, Paris)